衰老是自然界的常見現(xiàn)象�,伴隨著生命周期中遺傳損傷的累積,以及DNA損傷和修復(fù)之間失衡導(dǎo)致的基因突變�。
機(jī)體衰老過程中出現(xiàn)九個特征:基因組不穩(wěn)定性���、端粒消耗�、表觀遺傳改變、蛋白質(zhì)穩(wěn)態(tài)的丟失����、營養(yǎng)吸收能力下降、線粒體異常����、細(xì)胞衰老、干細(xì)胞耗竭��、細(xì)胞通訊的改變���。
衰老是細(xì)胞對內(nèi)源性和外源性壓力的反應(yīng)���,并限制了受損和衰老細(xì)胞的修復(fù)和更新。DNA損傷����、端粒縮短���、致癌損傷�、代謝應(yīng)激���、染色質(zhì)重塑����、表觀遺傳學(xué)改變和線粒體功能障礙等有害刺激均可誘導(dǎo)其發(fā)生。衰老是一個動態(tài)的過程����,漸進(jìn)的,多步驟的���,最終不可逆�����。
成體干細(xì)胞���,存在于身體的不同組織中,為器官提供生長和再生的能力���,以在其有生之年維持體內(nèi)平衡����?;钪挠袡C(jī)體的再生能力取決于其干細(xì)胞取代受損組織或破損細(xì)胞的能力和潛力,故而干細(xì)胞的衰老����,導(dǎo)致了機(jī)體整體的衰老。所有的衰老現(xiàn)象--組織退化--都可以被解釋為機(jī)體干細(xì)胞水平上的衰老跡象��。?
成體干細(xì)胞的衰老
(一)造血干細(xì)胞(HSC)的衰老改變
俄國科學(xué)家Alexander A.Maximow在1908年柏林的一次血液病大會上的提出干細(xì)胞的概念�,并于1909年正式發(fā)表闡述干細(xì)胞內(nèi)涵的文章。但現(xiàn)代干細(xì)胞研究始于1963年�����,Lou Siminovitch團(tuán)隊(duì)建立了檢測造血干細(xì)胞的方法����,并在小鼠的骨髓中發(fā)現(xiàn)了造血干細(xì)胞(HSC)。

(恩大DIVA全自動液態(tài)樣本分裝系統(tǒng)+二氧化碳細(xì)胞培養(yǎng)箱)
1����,免疫衰老
骨髓中的造血干細(xì)胞分化產(chǎn)生整個免疫系統(tǒng)的免疫細(xì)胞。適應(yīng)性免疫系統(tǒng)無法產(chǎn)生保護(hù)性免疫���,伴隨著免疫系統(tǒng)的保真度(fidelity)和效能(efficiency)下降��,被稱為免疫衰老����。免疫衰老的一個主要特征是炎癥和抗炎網(wǎng)絡(luò)之間的失衡,伴隨著持續(xù)的低度炎癥和對自身免疫反應(yīng)的更大易感性�。
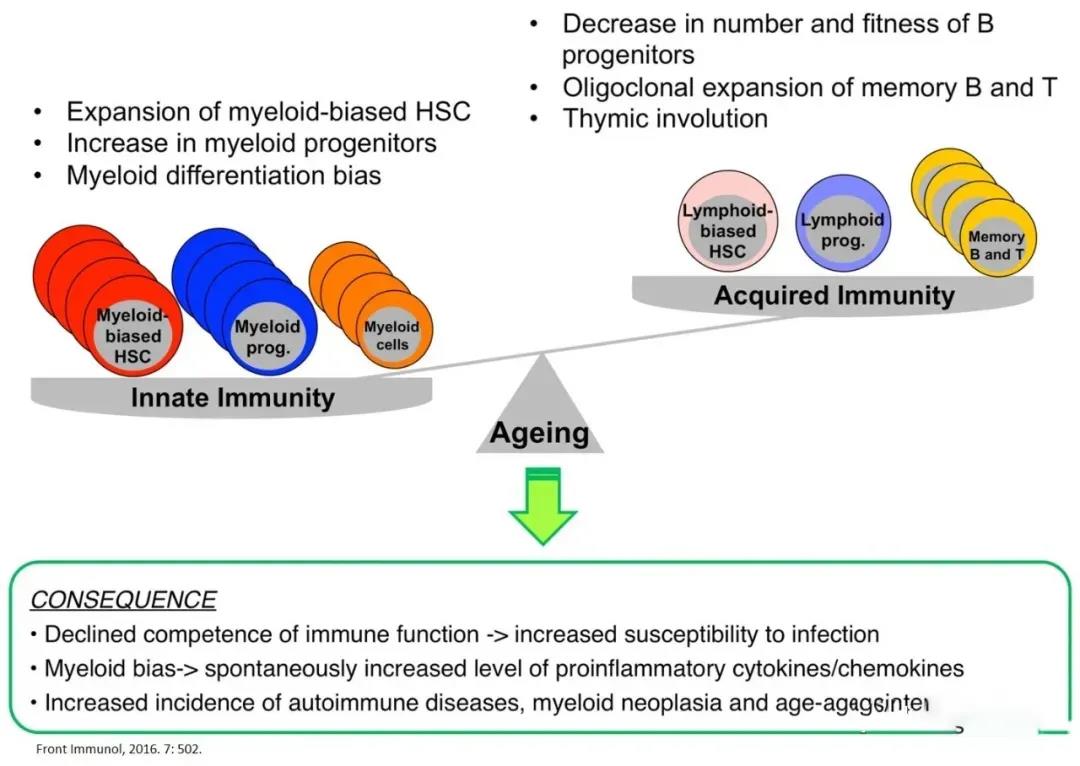
免疫系統(tǒng)的衰老,根源在于HSC的老化����。造血系統(tǒng)的老化表現(xiàn)為適應(yīng)性免疫系統(tǒng)和先天免疫系統(tǒng)的功能衰退,這種免疫細(xì)胞的衰老導(dǎo)致對病原微生物的高度易感性�����、疫苗接種的低效����,以及對自身免疫和血液系統(tǒng)惡性腫瘤發(fā)展的易感性增加。通過T細(xì)胞和B細(xì)胞共缺陷小鼠移植HSC的實(shí)驗(yàn)��,證明機(jī)體衰老時免疫系統(tǒng)的表型和功能變化主要是HSC在衰老過程中功能變化的結(jié)果�����,并且在很大程度上獨(dú)立于胸腺的功能���。
2�����,造血干細(xì)胞的衰老
大多數(shù)造血干細(xì)胞(HSC)在動態(tài)平衡狀態(tài)下是靜止的����,很少進(jìn)行周期自我更新或分化為子代的細(xì)胞�。造血受到內(nèi)在和外在機(jī)制的嚴(yán)格調(diào)控,這兩種機(jī)制平衡了靜止���、自我更新和分化�����,以維持正常的多譜系細(xì)胞的穩(wěn)定和系統(tǒng)重建����。
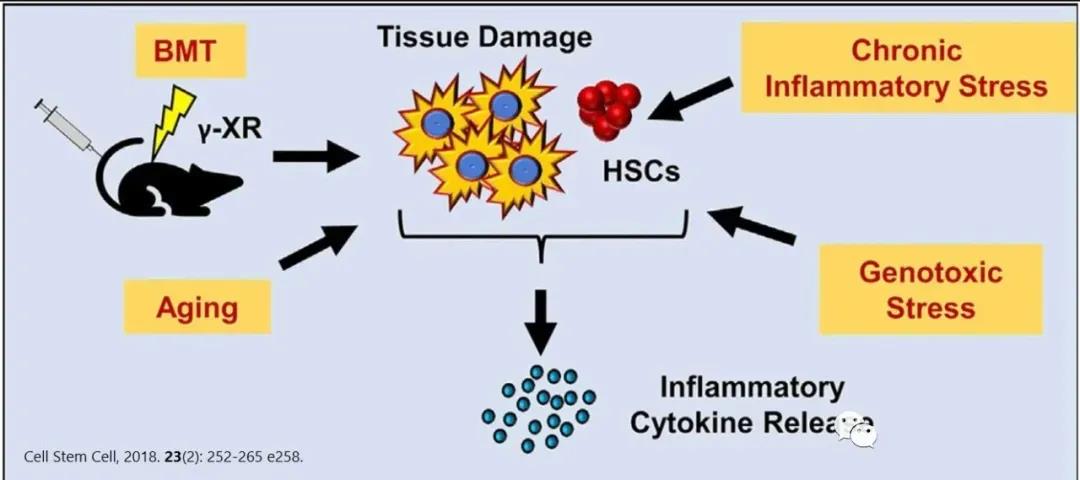
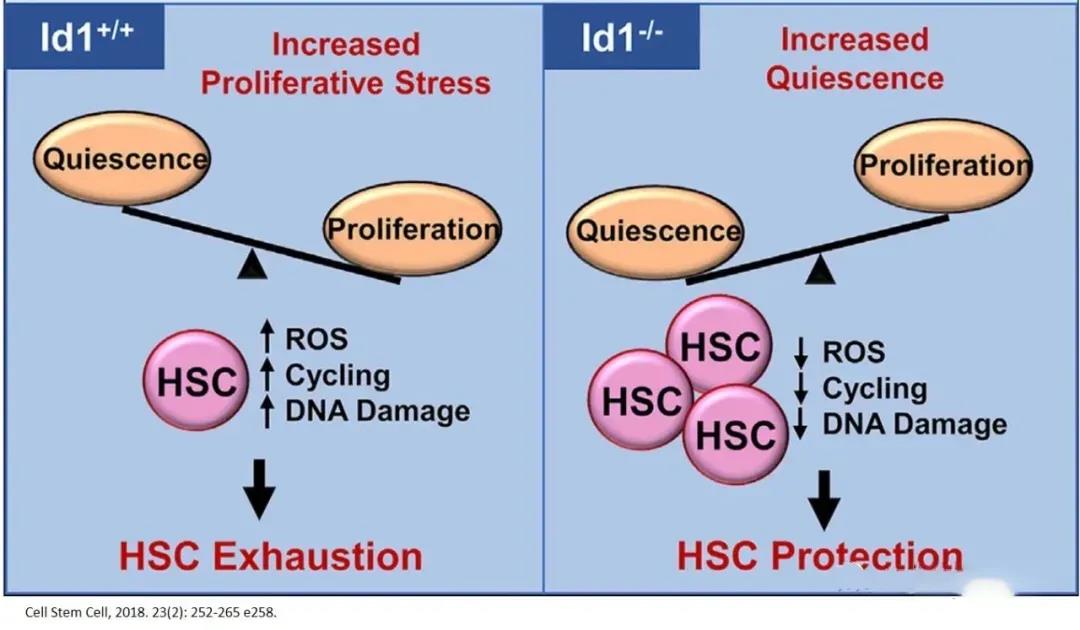
隨著每一次細(xì)胞分裂�����,HSC分化為血細(xì)胞的潛能下降���,同時����,潛能降低的子代造血祖細(xì)胞數(shù)量增加,以彌補(bǔ)單個干細(xì)胞功能的喪失��。因此�����,造血干細(xì)胞自身的大量增殖����,會導(dǎo)致造血干細(xì)胞的耗竭;而靜息狀態(tài)有利于維持造血干細(xì)胞的功能和年輕態(tài)干性��。在多種慢性和生理相關(guān)的應(yīng)激狀態(tài)下���,DNA結(jié)合蛋白的抑制子1(Id1)的缺失可以保護(hù)HSC免于耗盡�����,并促進(jìn)它們的靜止�����,因而靶向Id1可能會改善HSC在慢性應(yīng)激和衰老過程中的存活和功能�。
(二)間充質(zhì)干細(xì)胞(MSC)的衰老改變
1,年老MSC和年輕MSC的功能比較
人和小鼠一旦出生后�����,骨髓里面的MSC的含量持續(xù)下降��,雖然身體機(jī)能在青春期達(dá)到巔峰��,但是對于骨髓MSC來說��,MSC出道面世即是顛峰�����!
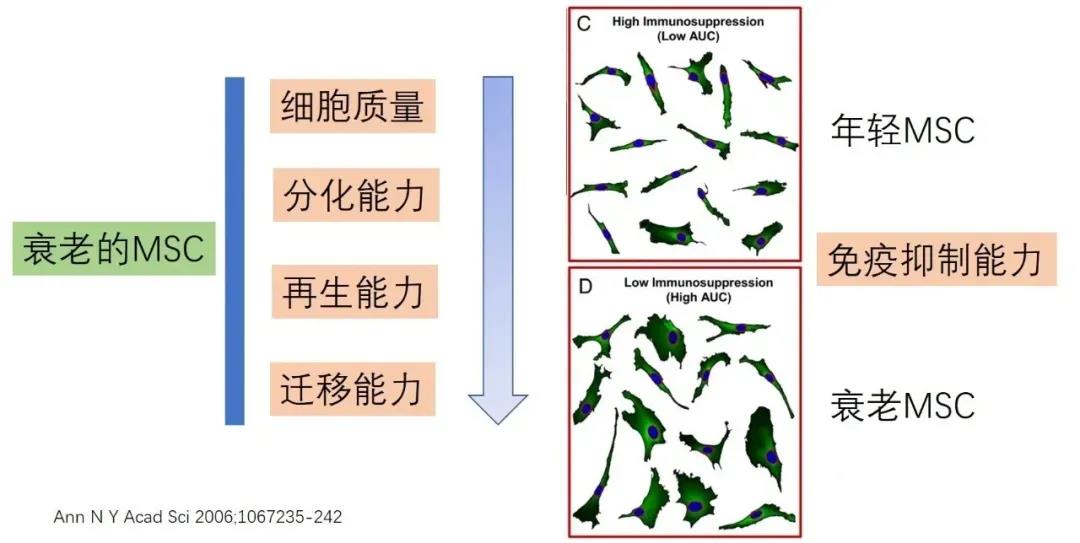
和年輕供體的MSC相比���,年紀(jì)大的供體來源的MSC增殖能力明顯下降,老齡MSC的胞體因?yàn)樗ダ隙龃?���。而且年紀(jì)大的供體來源的表達(dá)SA-β-gal陽性MSC數(shù)量增多。MSC的抗氧化能力也隨著年紀(jì)增大而逐漸下降����。年齡相關(guān)衰老的骨髓MSC多種膜蛋白也表達(dá)下降:CD13���、CD29、CD44�、CD73、CD90�����、CD105�����、CD146和CD166�����。有意思的是����,MSC的成脂/成骨/成軟骨分化是MSC的一個基礎(chǔ)特性,并不受年齡的影響���。成骨分化的效率和MSC的多項(xiàng)分化能力沒有必然的關(guān)聯(lián)性���。
?
肥胖者脂肪組織來源的MSC由于氧化和代謝應(yīng)激的增加���,這種應(yīng)激影響脂肪MSC線粒體,導(dǎo)致DNA損傷���、端?�?s短�����、增殖和干性減少(表現(xiàn)為NANOG、SOX2和OCT4的表達(dá)減少)���,增加凋亡和衰老��。有趣的是����,從皮下或內(nèi)臟脂肪等不同解剖部位分離的脂肪MSC的功能特性出現(xiàn)不同程度的差異���。肥胖環(huán)境還導(dǎo)致特定的DNA甲基化�����,導(dǎo)致線粒體形狀和數(shù)量的變化��,從而影響脂肪MSC細(xì)胞的功能特性��,涉及脂肪生成����、炎癥和免疫抑制。與年輕的MSC共培養(yǎng)的巨噬細(xì)胞表達(dá)M2表型的標(biāo)記Arg1和IL-10��,而與衰老的骨髓MSC共培養(yǎng)的巨噬細(xì)胞表達(dá)M1相關(guān)的TNF-α�。此外,年齡依賴性的脂肪生成增加����,可能通過激活過氧化物酶體增殖物激活受體γ2(PPAR-γ2)和CCAAT/增強(qiáng)子結(jié)合蛋白(CCAAT/EBP)而導(dǎo)致SASP狀態(tài)。
?
來自不同年齡捐贈者的BM-MSC的EV在其含量和免疫特征方面顯示出顯著的年齡差異�。在小鼠模型中,來自年輕MSC的胞外囊泡(EV)含有更高水平的自噬相關(guān)mRNA和sirtuins���,能使得衰老的造血干細(xì)胞(HSC)顯示出恢復(fù)的功能和活力���。相反�,來自老年捐贈者的骨髓MSC釋放SASP����,促進(jìn)了HSC的炎癥狀態(tài)而導(dǎo)致年輕HSC的功能損害。
2���,MSC的年齡性衰老(老化)
MSC經(jīng)過一定數(shù)量的細(xì)胞分裂后進(jìn)入衰老���,其形態(tài)學(xué)特征是細(xì)胞形態(tài)變大、不規(guī)則��,最終停止增殖����,而不適當(dāng)?shù)呐囵B(yǎng)條件明顯加速了這一過程。老化的MSC降低了多項(xiàng)分化潛能和組織修復(fù)所需的生長因子的產(chǎn)生����。衰老和氧化應(yīng)激可顯著增加骨髓細(xì)胞外小泡的miR-183-5p載量��,導(dǎo)致細(xì)胞增殖減少����、成骨分化減少���,并通過降低血紅素加氧酶-1(Hmox1)活性介導(dǎo)MSC衰老。
?
衰老的MSC表現(xiàn)出克隆生成和增殖能力降低�����,分化潛能偏向脂肪生成而減弱了成骨生成�����。在體內(nèi)����,MSC衰老意味著成骨能力降低,從而導(dǎo)致與年齡相關(guān)的疾病�,如骨質(zhì)疏松癥。因此���,MSC老化被認(rèn)為是骨折愈合隨年齡增長而受損的原因����。這也部分解釋了為何老年人容易出現(xiàn)骨質(zhì)酥松癥�,也解釋了為何老年骨髓中的脂肪細(xì)胞增多。

MSC的年齡相關(guān)性細(xì)胞衰老有關(guān)��,表現(xiàn)為增大、端?�?s短或p53/p21介導(dǎo)的DNA損傷堆積�����,DNA甲基化或組蛋白乙?���;軗p,ROS和一氧化氮(NO)水平升高���。DNA甲基轉(zhuǎn)移酶(DNMT)抑制劑5-氮雜胞苷(5-AZA)逆轉(zhuǎn)了MSC的衰老表型����,細(xì)胞增殖率增加���,氧化應(yīng)激產(chǎn)物積聚減少�,DNA甲基化狀態(tài)降低�。DNMT的抑制導(dǎo)致了活性狀態(tài)的組蛋白標(biāo)記的改變���,并誘導(dǎo)了p16和p21啟動子區(qū)域的CpG島去甲基化�����,上調(diào)p16和p21的表達(dá)����。所有這些數(shù)據(jù)表明,DNMTs和HDACs在調(diào)節(jié)MSC衰老中起著關(guān)鍵作用�����。
3�����,衰老相關(guān)分泌表型(SASP)
SASP是一種將細(xì)胞衰老與組織功能障礙聯(lián)系起來的新機(jī)制���。衰老細(xì)胞產(chǎn)生所謂的SASP分泌體��,SASP通過自分泌/旁分泌調(diào)節(jié)環(huán)路來維持和放大衰老���,涉及SASP產(chǎn)生細(xì)胞和周圍細(xì)胞,即SASP負(fù)責(zé)將衰老傳遞到相鄰細(xì)胞��,從而引發(fā)致命的退行性疾病��,并導(dǎo)致持續(xù)的低水平慢性炎癥(定義為炎性衰老)。SASP呈現(xiàn)出一種動態(tài)的成分�,包括促炎癥細(xì)胞因子(如IL-1α、IL-1β��、IL-6和IL-8)�、趨化因子、生長因子和蛋白酶(如MMP-1����、MMP-3和MMP-10),它們的組合取決于細(xì)胞類型����、微環(huán)境和衰老誘導(dǎo)機(jī)制。
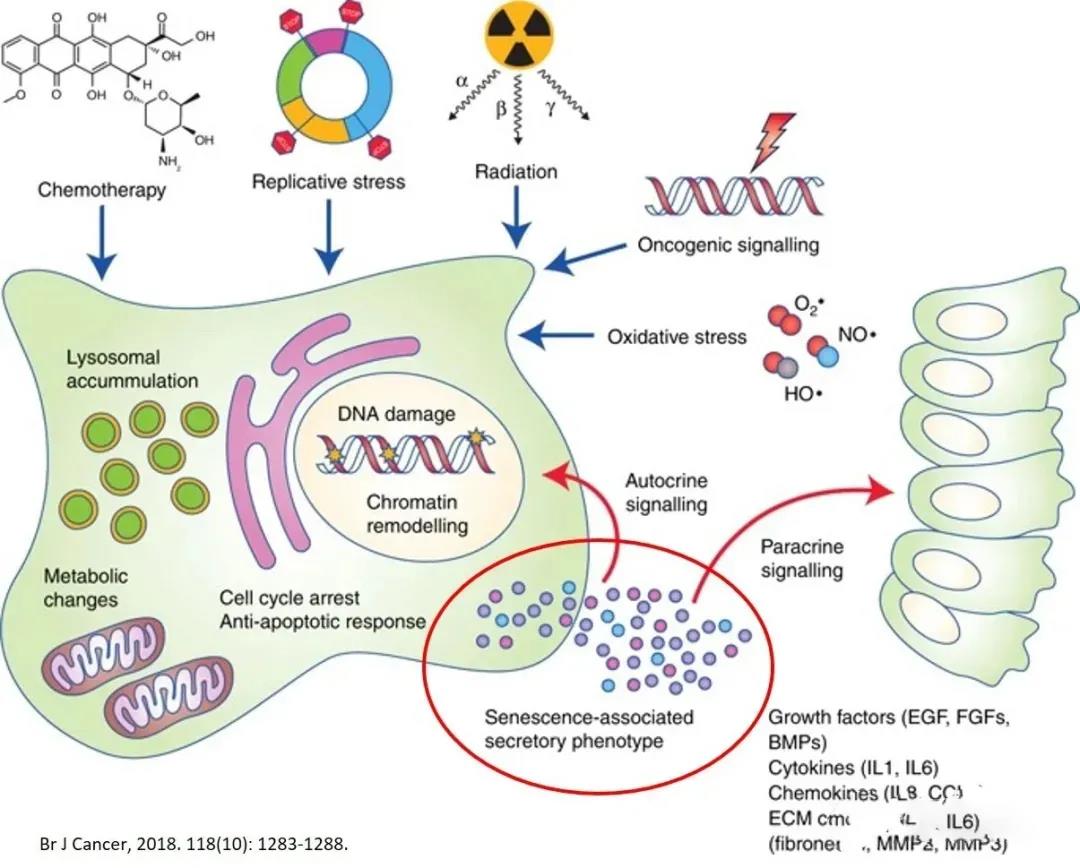
衰老的骨髓MSC出現(xiàn)SASP狀態(tài)�,過度釋放SASP相關(guān)的外泌體,包括IL-6��、IL-8�、IFN-γ、單核細(xì)胞趨化蛋白-1(MCP-1)和基質(zhì)金屬蛋白酶(MMP-2�、TIMP-2);由這些分泌分子引起的全身性炎癥反應(yīng)降低了MSC的免疫調(diào)節(jié)功能�����,促進(jìn)了癌癥進(jìn)展���。體內(nèi)骨髓衰老的MSC成脂分化增強(qiáng)�,而成骨分化減弱�����,同時分泌外泌體(miRNA-146a)和SASP��,刺激巨噬細(xì)胞的極化從M2型向M1型轉(zhuǎn)變����,從而加劇了炎性衰老。
(三)衰老與炎癥:炎性衰老(inflammaging)
組織和細(xì)胞在活體細(xì)胞周轉(zhuǎn)和新陳代謝過程中產(chǎn)生的所有類型的物質(zhì)���,包括細(xì)胞碎片�、代謝物���、不完全降解或非酶處理的產(chǎn)物�,被稱為“分子垃圾”�����。為了處理分子垃圾和維持體內(nèi)的動態(tài)平衡,已經(jīng)開發(fā)出幾種適應(yīng)性策略����,如識別PAMP或MAMP(微生物相關(guān)分子模式),它們可以直接激活模式識別受體(PRRs)和下游的炎癥級聯(lián)反應(yīng)�。動物中存在被稱為“自噬/有絲分裂吞噬”的救援機(jī)制,也是為了避免體內(nèi)細(xì)胞排泄物堆積不足�,但是其功能在炎癥環(huán)境中變得有缺陷,包括泛素蛋白酶體系統(tǒng)的失調(diào)和DNA損傷反應(yīng)的激活等����。
?

炎癥是抵御有害物質(zhì)入侵危及生命的一種防御機(jī)制,在兒童和成人時期維持內(nèi)環(huán)境穩(wěn)定�����,但慢性炎癥是心血管疾病�、糖尿病、癌癥和阿爾茨海默病等年齡相關(guān)疾病的共同病理基礎(chǔ)���,并可能是增加老年人大多數(shù)退行性疾病的發(fā)病率和死亡率的重要危險(xiǎn)因素�����。組織微環(huán)境的變化�,如細(xì)胞碎片的積累,代謝和激素信號的系統(tǒng)性變化�����,也可能導(dǎo)致慢性炎癥的發(fā)展���。單核/巨噬細(xì)胞系細(xì)胞對這些與年齡相關(guān)的變化至關(guān)重要,這些變化最終導(dǎo)致慢性炎癥性疾病的發(fā)展�。
?
大多數(shù)與衰老相關(guān)的疾病都是由共同的和相互依存的條件導(dǎo)致的,這些條件包括:慢性低度炎癥��、大分子/細(xì)胞器功能障礙�、干細(xì)胞功能障礙和衰老細(xì)胞堆積。在動物模型中遺傳和藥物消除衰老細(xì)胞可以延長壽命并延緩與年齡相關(guān)的病理的發(fā)生����。細(xì)胞水平上的衰老可能是炎癥的原因。隨著年齡的增長�����,組織中積累的衰老細(xì)胞分泌促炎細(xì)胞因子���,即為“衰老相關(guān)分泌表型”(SASP)�����,有助于炎癥的發(fā)生��。因此�����,長期以來���,炎癥一直被認(rèn)為是許多組織癌癥發(fā)展的驅(qū)動力��。所以����,消炎很重要��!
版權(quán)聲明
我們尊重分享���,文章�、圖片均來源自網(wǎng)絡(luò)���,版權(quán)歸原作者所有��。如有異議�,請聯(lián)系本篇作者(或平臺客服),我們會及時處理���。