細胞周期蛋白D(CyclinD����,細胞周期蛋白D1�、D2和D3)是驅(qū)動細胞分裂的細胞周期核心引擎的關(guān)鍵組成部分。目前����,有關(guān)CyclinD的研究已經(jīng)取得一定進展,人們對CyclinD 的特性及功能也有了初步了解����,認識到CyclinD在細胞周期調(diào)控和腫瘤的發(fā)生發(fā)展過程中起著關(guān)鍵而多樣的作用。但是�,對CyclinD的研究仍需深入����,以期闡明腫瘤的發(fā)病機制��,為腫瘤的治療提供更有效的方法�����。
近期����,頂尖學術(shù)期刊《自然》在線連發(fā)三篇論文。這3篇論文里���,由美國�、意大利����、丹麥科學家領(lǐng)導的多支團隊從不同角度切入,找到了一個叫做AMBRA1的關(guān)鍵調(diào)控蛋白��,并介紹了其調(diào)控周期蛋白D的機制��,以及對癌癥治療的潛在意義。



在細胞分裂過程中��,細胞周期蛋白D結(jié)合并激活細胞周期蛋白依賴性激酶4(CDK4)和細胞周期蛋白依賴性激酶6(CDK6)��。這些細胞周期蛋白-CDK4/6激酶給腫瘤抑制蛋白RB1、RBL1和RBL2添加磷酸基團�,從而推動了細胞分裂。細胞周期蛋白D-CDK4/6激酶的不受控制激活是許多類型癌癥發(fā)展的驅(qū)動力�����。
隨著CDK4/6激酶的小分子抑制劑進入臨床��,人們對細胞周期蛋白D-CDK4/6生物學的興趣越來越大��。這些化合物的臨床試驗結(jié)果令人矚目��,證明它們有能力延長乳腺癌患者的生存時間�����。CDK4/6抑制劑帕博西尼(palbociclib)���、瑞博西尼(ribociclib)和阿貝西利(abemaciclib)被批準用于治療晚期乳腺癌����。此外�����,這些藥物正在幾百項臨床試驗中對許多不同類型的癌癥進行測試。
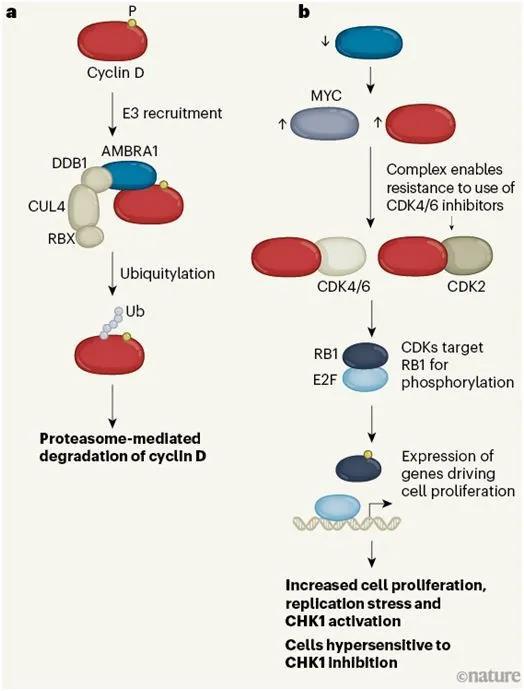
細胞周期蛋白D的破壞��,圖片來自Nature, 2021, doi:10.1038/d41586-021-00889-0��。
自20世紀90年代發(fā)現(xiàn)細胞周期蛋白D以來�,人們對其進行了深入研究,但它們在細胞周期中是如何降解的仍有爭議�。細胞周期蛋白D的羧基末端區(qū)域磷酸化觸發(fā)這些蛋白被稱為泛素-蛋白酶體系統(tǒng)的降解途徑所破壞。在這個系統(tǒng)中�,由泛素激活酶(E1)、泛素結(jié)合酶(E2)和泛素連接酶(E3)組成的級聯(lián)活性����,通過一個稱為泛素化的過程,將幾個稱為泛素的小蛋白分子鏈附著在目標蛋白上�����。然后,這些泛素化的蛋白注定要在一種稱為蛋白酶體的蛋白復合物中遭受降解�。
最大的E3家族是cullin–RING連接酶(CRL)。CRL由一個cullin蛋白���、一個RING蛋白(可招募E2)���、一個銜接蛋白和許多不同的底物受體蛋白之一組成,其中底物受體蛋白負責將目標蛋白招募到E3復合物中���。稱為CRL1的E3的幾種底物受體被認為與細胞周期蛋白D1的降解有關(guān)����,而其他的E3底物受體則被認為靶向細胞周期蛋白D2和D3以便它們隨后遭受蛋白酶體破壞����。

此外��,細胞周期蛋白D1被后期促進復合物(anaphase-promoting complex)泛素化��,這種后期促進復合物是一種靶向幾種細胞周期蛋白的E3復合物���。與這些模型相反����,其他研究則指出細胞周期蛋白D1的水平和穩(wěn)定性不受這些蛋白耗竭的影響����,這表明一些其他的E3調(diào)節(jié)著細胞周期蛋白D1的降解�。
這三項新的研究指出細胞周期蛋白D1、D2和D3被稱為CRL4的E3泛素化����,隨后遭受蛋白酶體降解,CRL4使用蛋白AMBRA1作為它的底物受體��。人們已經(jīng)知道AMBRA1在調(diào)節(jié)自噬方面具有關(guān)鍵作用����,其中自噬是細胞降解受損細胞器或蛋白聚集物的過程����。AMBRA1也已被確定為E3(包括CRL4)的底物受體���。
通過一系列實驗����,利用包括細胞生物學����、分子生物學和發(fā)育遺傳學等領(lǐng)域的技術(shù),這三項新的研究證實在正常細胞���、癌細胞以及發(fā)育中的小鼠胚胎中��,AMBRA1的耗竭會導致細胞周期蛋白D水平的上升����。與具有正常數(shù)量AMBRA1的細胞相比�����,這導致了更大的RB1磷酸化和更多的細胞增殖。
第三項研究還顯示���,AMBRA1的耗盡會提高轉(zhuǎn)錄因子蛋白N-MYC的水平�����。這些研究人員之前已發(fā)現(xiàn)���,AMBRA1調(diào)節(jié)一個相關(guān)的轉(zhuǎn)錄因子---c-MYC---的穩(wěn)定性和活性。MYC家族蛋白可以上調(diào)細胞周期蛋白D和細胞周期蛋白E的表達�,從而加速細胞周期的進展。
這些觀察表明�����,AMBRA1可能作為一種腫瘤抑制蛋白發(fā)揮作用�����。事實上���,只有AMBRA1編碼基因的一個功能性拷貝的小鼠比具有這個基因的兩個功能性拷貝的正常小鼠有更高的肺部、肝臟和腎臟腫瘤發(fā)生率����。這三項新的研究提供了令人信服的證據(jù)來支持這一觀點。
這些研究人員證實�,AMBRA1基因在人類癌癥中發(fā)生了突變。正如預期的那樣�����,鑒于AMBRA1能夠促進細胞周期蛋白D1的降解����,他們報告說,人類腫瘤中AMBRA1的水平與細胞周期蛋白D1的水平呈反比關(guān)系。
腫瘤中AMBRA1的低水平與癌癥患者的預后不佳有關(guān)�����。不論是AMBRA1在人類腫瘤細胞系中的實驗性失活��,還是在小鼠細胞中經(jīng)過基因改造后發(fā)生促癌突變而導致的AMBRA1實驗性失活��,均會增加這些細胞在注射到小鼠體內(nèi)后的腫瘤形成潛力����。
此外,在Kras基因突變版本驅(qū)動的肺癌小鼠模型中�,AMBRA1的基因剔除促進了腫瘤的形成,而且這些AMBRA1缺乏的腫瘤具有高于正常水平的細胞周期蛋白D��?��?傊?��,這些研究表明����,AMBRA1在正常情形下抑制細胞增殖,主要是通過阻止細胞周期蛋白D達到較高的水平��。
第一項研究和第二項研還證實,AMBRA1的丟失以及細胞周期蛋白D的同時增加��,導致人類腫瘤細胞對CDK4/6抑制劑的敏感性下降�。有趣的是,這些作者報告說�����,在AMBRA1缺失的細胞中����,細胞周期蛋白D1不是主要與CDK4/6合作,而是與細胞周期蛋白依賴性激酶CDK2形成一種具有催化活性的復合物�,而且這種復合物對CDK4/6抑制劑不敏感。
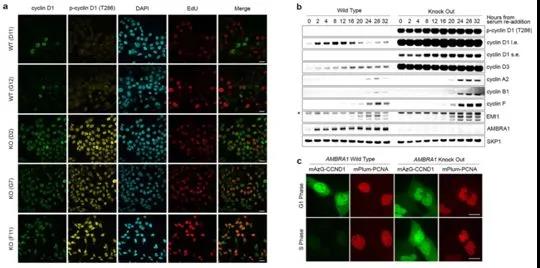
在正常細胞周期中,在營養(yǎng)剝奪和基因毒性脅迫后,AMBRA1的缺失可調(diào)節(jié)細胞周期蛋白D���。圖片來自Nature, 2021, doi:10.1038/s41586-021-03445-y�����。
第三項研究還表明�,AMBRA1的喪失以及由此產(chǎn)生的細胞周期蛋白D(也可能還有其他蛋白���,如c-MYC)的上升��,引發(fā)了DNA損傷和復制壓力(replication stress)�����,這伴隨著一種叫做CHK1的細胞周期檢查點激酶(cell cycle checkpoint kinase, CHK)的激活�����。重要的是��,這些作者報告說����,AMBRA1缺失的癌細胞對CHK1抑制劑治療不敏感��,這表明存在靶向AMBRA1缺失腫瘤的潛在治療機會�。
這些令人興奮的結(jié)果提出了幾個關(guān)鍵問題。例如���,AMBRA1水平的下降是否是人類腫瘤對CDK4/6抑制劑產(chǎn)生現(xiàn)有抵抗性和獲得性抵抗性的基礎(chǔ)���?隨著AMBRA1的耗盡,細胞周期蛋白D的上升是否是導致對CDK4/6抑制劑產(chǎn)生抵抗性的唯一因素
對乳腺癌患者臨床試驗的分析顯示�,編碼細胞周期蛋白D1的基因的額外拷貝的存在,或腫瘤中細胞周期蛋白D1信使RNA或蛋白的水平�����,與患者對CDK4/6抑制劑的反應(yīng)之間沒有關(guān)聯(lián)�����。
事實上�����,第二項研究發(fā)現(xiàn)����,經(jīng)驅(qū)動后細胞周期蛋白D表達量高于正常水平的人類癌細胞并不完全再現(xiàn)AMBRA1耗盡時觀察到的抑制劑抵抗性特征。也許其他受到AMBRA1調(diào)控的蛋白��,如可以上調(diào)細胞周期蛋白E并激活細胞周期蛋白E-CDK2復合物的c-MYC����,對治療抵抗性有貢獻。
第一項研究和第二項研究觀察到在AMBRA1耗盡的細胞中形成抵抗CDK4/6抑制劑的細胞周期蛋白D-CDK2復合物�,這很耐人尋味。這種“非典型”復合物以前被發(fā)現(xiàn)是對CDK4/6抑制產(chǎn)生獲得性抵抗性的基礎(chǔ)���。這些作者推測���,AMBRA1耗盡在某種程度上促進了這些細胞周期蛋白D-CDK2復合物的形成,這與細胞周期蛋白D水平的升高一起�,導致了對CDK4/6抑制劑的抵抗性。第三項研究提出的一個特別令人興奮的可能性是�����,CHK1抑制劑可用于治療AMBRA1水平較低的對CDK4/6抑制劑有抵抗性的腫瘤。
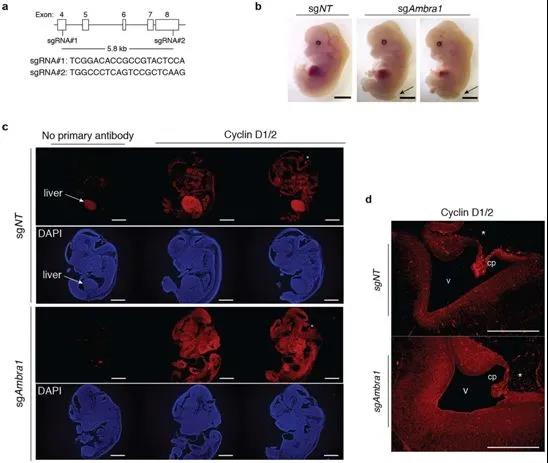
小鼠胚胎中的AMBRA1缺失導致細胞周期蛋白D水平升高���。圖片來自Nature, 2021, doi:10.1038/s41586-021-03474-7���。
對AMBRA1在人類癌癥中的作用開展進一步研究是有必要的。AMBRA1的腫瘤抑制功能主要是由細胞周期蛋白D1或c-MYC介導的�,還是也由其他靶標介導的?不再產(chǎn)生RB1的腫瘤細胞不需要細胞周期蛋白D來促進細胞周期進展�����,因此�����,如果細胞周期蛋白D是AMBRA1的主要靶標,那么預計在產(chǎn)生RB1的腫瘤中會觀察到AMBRA1的缺失�。
此外,人類腫瘤中的AMBRA1缺失是否與影響細胞周期蛋白D羧基末端的突變相互排斥仍有待確定����,這可能會使細胞周期蛋白D對AMBRA1介導的降解產(chǎn)生抵抗性。
另一個未解決的問題是����,正如第二項研究報告的那樣,為何AMBRA1的低表達與高水平的細胞周期蛋白D1相關(guān)�����,并與具有特定類型基因改變(如Kras突變)的肺部腫瘤的不良生存率相關(guān)����。對于那些具有編碼EGFR蛋白的基因突變版本或具有野生型Kras的肺部腫瘤則沒有觀察到這種影響。
不管這些問題的答案如何�����,這三項新的研究令人印象深刻��,改善了科學家們對細胞周期進展機制的理解����。